製薬企業の方へ
当院では、ヘルシンキ宣言(人間を対象とする医学研究の倫理原則)ならびにGCP(Good Clinical Practice)を順守し、治験・臨床研究を行っております。
治験審査委員会
市立伊丹病院 治験審査委員会は、通例毎月第3火曜日に開催しております。
治験審査委員会への資料の提出は、開催日の3週間前までにお願いいたします。
申請から治験開始までの流れ
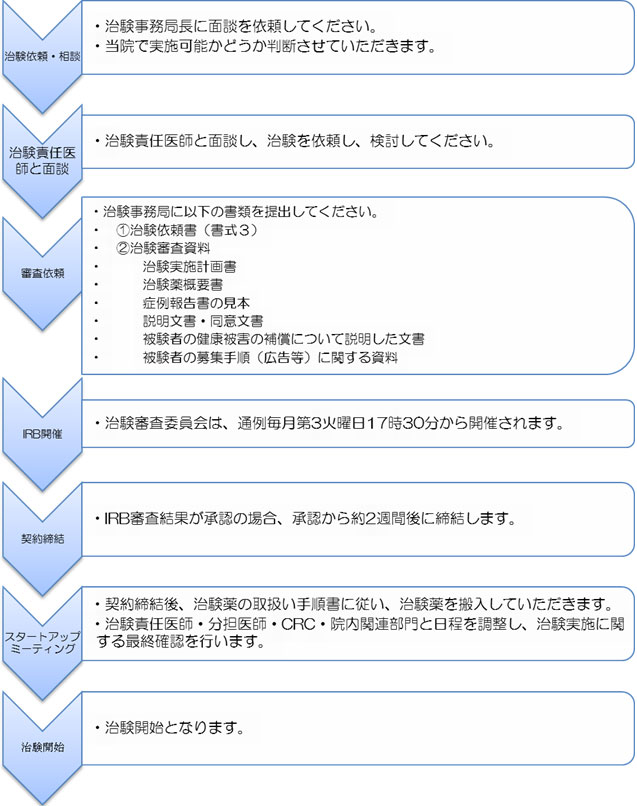
治験手続き書類
統一書式一覧 (PDFファイル)
| 統一書式番号 | 資料名 |
|---|---|
| 書式00 | 統一書式表紙 |
| 書式1 | 履歴書 |
| 書式2 | 治験分担医師・治験協力者 リスト |
| 書式3 | 治験依頼書 |
| 書式4 | 治験審査依頼書 |
| 書式5 | 治験審査結果通知書 |
| 書式6 | 治験実施計画書等修正報告書 |
| 書式7 | (欠番) |
| 書式8 | 緊急の危険を回避するための治験実施計画書からの逸脱に関する報告書 |
| 書式9 | 緊急の危険を回避するための治験実施計画書からの逸脱に関する通知書 |
| 書式10 | 治験に関する変更申請書 |
| 書式11 | 治験実施状況報告書 |
| 書式12 | 重篤な有害事象に関する報告書(医薬品治験) |
| 書式13 | 重篤な有害事象に関する報告書(医薬品製造販売後臨床試験) |
| 書式14 | 重篤な有害事象及び不具合に関する報告書(医療機器治験) |
| 書式15 | 重篤な有害事象及び不具合に関する報告書(医療機器製造販売後臨床試験) |
| 書式16 | 安全性情報等に関する報告書 |
| 書式17 | 治験終了(中止・中断)報告書 |
| 書式18 | 開発の中止等に関する報告書 |
| 書式19 | 重篤な有害事象及び不具合に関する報告書(再生医療等製品治験) |
| 書式20 | 重篤な有害事象及び不具合に関する報告書(再生医療等製品製造販売後臨床試験) |
| 詳細記載用書式 | (書式12、書式13、書式14、書式15、書式19、書式20の詳細記載用) |
| 参考書式1 | 治験に関する指示・決定通知書 |
| 参考書式2 | 直接閲覧実施連絡票 |
施設書式一覧
| 施設書式番号 | 資料名 |
|---|---|
| 施設書式1 | 治験事務局長指名書(治験実施医療機関の長→治験事務局長) |
| 施設書式2 | 治験事務局業務代行委託書 (治験実施医療機関の長→治験支援機関代表者) |
| 施設書式3 | 記録保存責任者指名書(治験実施医療機関の長→記録保存責任者) |
| 施設書式4 | 治験薬管理者指名書(治験実施医療機関の長→治験薬管理者) |
| 施設書式5 | 安全性情報等に関する見解 |
| 施設書式6 | 異議申立書(治験責任医師→治験実施医療機関の長) |
| 施設書式7-1 | 治験契約書(医薬品治験 2者) |
| 施設書式7-2 | 治験契約書(医薬品治験 3者) |
| 施設書式7-5 | 治験契約書(医療機器治験 2者) |
| 施設書式8-1 | 治験契約内容変更に関する覚書(2者) |
| 施設書式8-2 | 治験契約内容変更に関する覚書(3者) |
| 施設書式9 | 治験薬管理担当者指名書(兼名簿) |
| 施設書式10 | 治験審査委員会委員指名書(兼名簿) |
| 施設書式11 | 治験審査委員会外部委員委嘱書(治験実施医療機関の長→治験審査委員会外部委員) |
| 施設書式12 | 治験審査委員会委員略歴 |
| 施設書式13 | 治験審査委員会開催委託書(治験実施医療機関の長→治験審査受託医療機関の長) 治験審査委員会開催受託書(治験審査受託医療機関の長→治験実施医療機関の長) |
| 施設書式14 | 治験審査委員会の審議委受託に関する覚書 (治験実施医療機関の長←→治験審査受託医療機関の長) |
| 施設書式15 | 治験実施医療機関概要書 |
| 施設書式16 | 治験審査委員会開催通知書 |
| 施設書式17 | 事務局員指名書(兼名簿) |
| 施設書式18-1 | 治験審査委員会議事録(議事要旨雛)Ⅰ相用 |
| 施設書式18-2 | 治験審査委員会議事録(議事要旨雛)Ⅱ相用 |
| 施設書式18-3 | 治験審査委員会議事録(議事要旨雛)Ⅲ相用 |
| 施設書式19 | 治験実施計画書からの逸脱(緊急の危険回避の場合を除く)に関する報告一覧 |
